5.FUNCION OXIDO
Los ácidos son compuestos binarios formados por combinación química del oxígeno con otro elemento. En la naturaleza, muchos elementos metálicos y no metálicos se encuentran formando óxidos.
Artificialmente, los óxidos se forman generalmente a altas temperaturas.
Ejemplo:
2 Fe + O2 → 2 FeO
S + O2 → SO2
Tipos de Óxidos:
óxidos metálicos u óxidos básicos
óxidos no metálicos u óxidos ácidos
Formulación General: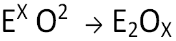
X : valencia del elemento E
Se debe recordar que el oxígeno, debido a su mayor electronegatividad, actúa con un número de oxidación–2 (O-2 ión óxido); por lo tanto el elemento E debe actuar con número de oxidación positiva.
A continuación indicamos el número de oxidación de los principales elementos metálicos y no metálicos frente al oxígeno.
 Ciertos elementos forman óxidos básicos y óxidos ácidos, y se les llama anfóteros; otros forman óxidos neutros (no tienen propiedades ácidas ni básicas). A continuación indicaremos los mas notables.
Ciertos elementos forman óxidos básicos y óxidos ácidos, y se les llama anfóteros; otros forman óxidos neutros (no tienen propiedades ácidas ni básicas). A continuación indicaremos los mas notables.
Los ácidos son compuestos binarios formados por combinación química del oxígeno con otro elemento. En la naturaleza, muchos elementos metálicos y no metálicos se encuentran formando óxidos.
Artificialmente, los óxidos se forman generalmente a altas temperaturas.
Ejemplo:
2 Fe + O2 → 2 FeO
S + O2 → SO2
Tipos de Óxidos:
óxidos metálicos u óxidos básicos
óxidos no metálicos u óxidos ácidos
Formulación General:
X : valencia del elemento E
Se debe recordar que el oxígeno, debido a su mayor electronegatividad, actúa con un número de oxidación–2 (O-2 ión óxido); por lo tanto el elemento E debe actuar con número de oxidación positiva.
A continuación indicamos el número de oxidación de los principales elementos metálicos y no metálicos frente al oxígeno.

| Elemento | E.O. en óxidos básicos | E.O. en óxidos ácidos | E.O. en óxidos neutros |
| Mn | +2 , +3 | +4 , +6 , +7 | |
| V | +2 , +3 | +4 , +5 | |
| Cr | +2 , +3 | +3 , +6 | |
| N | +3 , +5 | +1 , +2 , +4 | |
| Bi | +3 | +5 |
Óxidos básicos
Son los óxidos formados por la combinación quimica del oxigeno con metales. Estos elementos son generalmente solidos a temperatura ambiental y poseen enlace ionico. Por reacción química con el H2O dan origen a los hidróxidos, que poseen propiedades básicas, por ellos se denominan óxidos básicos.Nomenclaturas de los óxidos básicos:
• En la nomenclatura tradicional o clásica, se utiliza el nombre genérico óxido seguido del nombre del metal terminado en el sufijo oso para la menor valencia, o de lo contrario el sufijo ico para la mayor valencia. Cuando poseen una sola valencia también se puede emplear el sufijo ico.
• En la nomenclatura stock, si el metal posee 2 o más valencias, éstas se indican mediante números romanos, y si el metal posee 1 sola valencia entonces se omite el número romano.
Ejemplos:
Formulación
|
Fórmula
|
N. tradicional
|
N. stock
|
Fe+3 + O-2
|
Fe2O3
|
óxido férrico
|
óxido de hierro (III)
|
Pb+4 + O-2
|
PbO2
|
óxido plumbico
|
óxido de plomo (IV)
|
Au+1 + O-2
|
Au2O
|
óxido auroso
|
óxido de oro (I)
|
Sn+2 + O-2
|
SnO
|
óxido estañoso
| óxido de estaño (III) |
Al+3 + O-2
| Al2O3 | óxido de aluminio (ico) | óxido de aluminio * |
Debe recordarse que el aluminio tiene valencia única.
Algunos óxidos poseen nombres comunes o vulgares, muchos de los cuales tienen origen geológico, es decir derivan del estudio de los minerales; otros son nombres comerciales.
Ejemplos:
CaO : cal viva
Fe2O3 : hematita
MnO2 : pirolusita
BaO : barita
SnO2 : casiterita
ZnO : cincita
MgO : magnesia
Al2O3 : alúmina , corindón
Óxidos dobles:
Son compuestos que forma el oxígeno con algunos metales como: Fe, Pb, Co, Ni, etc. A temperatura ambiental son sólidos. Se consideran como una combinación de dos óxidos básicos de un metal donde este tiene valencia 2 , 3 ó 2 , 4; generalmente la fórmula general es: E2O4
Ejemplos:
Fórmula
|
N. tradicional
|
Nombre sistemático
|
Nombre común
|
Fe3O4
|
óxido doble de hierro
|
tetróxido de trihierro
|
magnetita (imán natural)
|
Pb3O4
|
óxido doble de plomo
|
tetróxido de triplomo
|
minio de plomo
|
Son óxidos formados por la combinación del oxígeno con elementos no metálicos, aunque también se encuentra en esta categoría algunos óxidos de metales que son anfóteros como el vanadio, cromo y manganeso.
En la nomenclatura tradicional se denomina anhidrido (quiere decir sin H2O) que es el nombre genérico, seguido del nombre del elemento con un prefijo y/o sufijo, dependiendo de la valencia con que actúe. El siguiente cuadro nos muestra la nomenclatura de estos óxidos, según la valencia del no metal.
Caso
|
Valencia
|
Nombre Genérico
|
Prefijo
|
Elemento
| Sufijo |
| 1 valencia | única | anhidrido | - | elemento | ico |
| 2 valencias | menor | anhidrido | - | elemento | oso |
| 2 valencias | mayor | anhidrido | - | elemento | ico |
| 3 valencias | menor | anhidrido | hipo | elemento | oso |
| 3 valencias | intermedio | anhidrido | - | elemento | oso |
| 3 valencias | mayor | anhidrido | - | elemento | ico |
| 4 valencias | menor | anhidrido | hipo | elemento | oso |
| 4 valencias | intermedio menor | anhidrido | - | elemento | oso |
| 4 valencias | intermedio mayor | anhidrido | - | elemento | ico |
| 4 valencias | mayor | anhidrido | per | elemento | ico |
En el caso de valencia única o fija, también se nombra indicando solo el nombre del elemento.
Ejemplos:
1. El boro posee una sola valencia igual a 3
B3O2- → B2O3
anhidrido de boro ó anhidrido bórico
2. El carbono posee dos valencias : 2 y 4
C2O2- → CO , anhidrido carbonoso
C4O2- → CO2 , anhidrido carbónico
3. El cloro posee 4 valencias (1, 3, 5, 7)
Cl1O2- → Cl2O , anhidrido hipocloroso
Cl3O2- → Cl2O3 , anhidrido hipocloroso
Cl5O2- → Cl2O5 , anhidrido hipocloroso
Cl7O2- → Cl2O7 , anhidrido hipocloroso
Si un elemento posee valencia igual a 7, aunque tuviera valencia única debe empelarse el sufijo per o hiper y el sufijo ico.
Ejemplos:
El manganeso como no – metal posee 3 valencias (4, 6 , 7)
MnO2 → anhidrido manganoso
MnO3 → anhidrido mangánico
MnO7 → anhidrido permangánico
Para óxidos ácidos, la IUPAC recomienda el uso de nomenclatura sistemática y no la nomenclatura de stock.
Ejemplos:
Fórmula
|
N. sistemática
|
N. stock (no recomendable)
|
V2O5
|
pentóxido de divanadio
|
óxido de vanadio (V)
|
TeO3
|
trióxido de teluro
|
óxido de teluro (III)
|
Cl2O7
|
heptóxido de dicloro
|
óxido de cloro (VII)
|
CO
|
monóxido de carbono
| óxido de carbono (II) |
| I2O3 | trióxido de diyodo | óxido de yodo (III) |
6.FUNCION HIDRÓXIDO
Esto se obtiene cuando se combina un óxido con agua.
óxido + agua ———› hidróxido
Se llama radical al grupo de 2 o más átomos que funcionan con una sola valencia.
Nomenclatura
Para nombrarlos, se escribe la palabra "hidróxido" la preposición "de" y el nombre del metal. Si el metal tiene varias valencias, se escribe entre paréntesis con número romano la valencia con que actuó dicho metal.
Ejemplo: el plomo tiene dos valencias por lo que se tiene:
En forma simplificada se pueden formar los hidróxidos combinando
directamente el metal con el radical (OH)-1
se cruzan las valencias y queda:
Propiedades de las bases
a) Tienen sabor a lejía (jabón).
b) Reaccionan con los ácidos produciendo sal y agua con desprendimiento de energía y a la reacción se denomina Neutralización.
c) Causan escozor al contacto con la piel - la sosa cáustica que se usa en la cocina NaOH o la cal
d) Son untuosos y resbalosos al tacto.



Jjejej Excelente Blog Tiene Buenos Ejemplos y Muy Entendible El Tema
ResponderBorrar